kategória: Najlepšie články » Začiatočníci elektrikári
Počet zobrazení: 70526
Komentáre k článku: 0
Galvanické články - zariadenie, princíp činnosti, typy a hlavné charakteristiky
Predpoklady pre vzhľad galvanických článkov. Trocha histórie. V roku 1786 objavil taliansky profesor medicíny, fyziológ Luigi Aloisio Galvani zaujímavý fenomén: svaly zadných nôh čerstvo otvorenej mŕtvoly žaby zavesenej na medených háčkoch sa stiahli, keď sa ich vedec dotkol oceľovým skalpelom. Galvani okamžite dospel k záveru, že išlo o prejav „živočíšnej elektriny“.
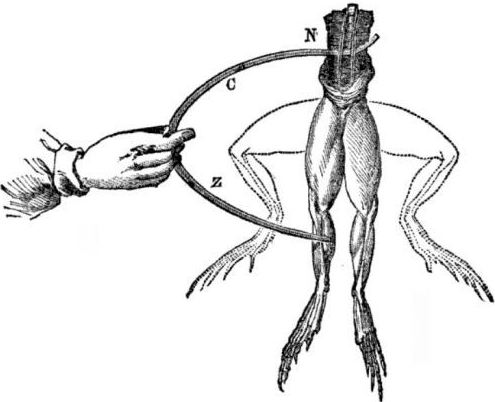
Po smrti Galvaniho jeho súčasný Alessandro Volta ako chemik a fyzik opíše a verejne preukáže realistickejší mechanizmus výskytu elektrického prúdu, keď prídu do styku rôzne kovy.
Volta po sérii experimentov príde k jednoznačnému záveru, že v obvode sa objavuje prúd kvôli prítomnosti dvoch vodičov rôznych kovov umiestnených v tekutine, a to vôbec nie je „živočíšna elektrina“, ako si myslel Galvani. Zášklby žabích stehienok boli dôsledkom pôsobenia prúdu vznikajúceho pri kontakte s rôznymi kovmi (medené háčiky a oceľový skalpel).
Volta ukáže tie isté javy, ktoré Galvani ukázal na mŕtvej žabe, ale na úplne neživom domácom elektrometri, av roku 1800 poskytne presné vysvetlenie súčasného stavu: „vodič druhej triedy (kvapalina) je v strede a je v kontakte s dvoma prvotriednymi vodičmi dvoch rôznych kovy ... V dôsledku toho vzniká elektrický prúd v jednom alebo druhom smere. “

V jednom z prvých experimentov Volta spustil dve platne - zinok a meď - do kyslej nádoby a spojil ich drôtom. Potom sa zinková platňa začala rozpúšťať a na medenej oceli sa vytvorili bublinky plynu. Volta navrhol a preukázal, že elektrickým prúdom preteká drôt.
Tak bol vynájdený „Volta element“ - prvý galvanický článok. Kvôli pohodlnosti mu Volta dal tvar vertikálneho valca (stĺpa), pozostávajúceho zo vzájomne prepojených krúžkov zinku, medi a tkaniny napustenej kyselinou. Voltový pól vysoký pol metra vytvoril napätie citlivé na ľudí.
Od začiatku výskumu položil meno Luigi Galvani zdroj chemického prúdu v jeho mene si zachoval spomienku.
Galvanický článok Je chemický zdroj elektrického prúdu založený na interakcii dvoch kovov a / alebo ich oxidov v elektrolyte, ktorý vedie k vzniku elektrického prúdu v uzavretom okruhu. V galvanických článkoch sa teda chemická energia premieňa na elektrickú energiu.
Bunky dnes

Bunky sa dnes nazývajú batérie. Rozsiahle sú tri typy batérií: slaný (suchý), alkalický (v preklade z angličtiny sa tiež nazýva alkalický, alkalický) a lítium. Princíp ich práce je rovnaký, ako opísal Volta v roku 1800: dva kovy interagujú prostredníctvom elektrolytua vo vonkajšom uzatvorenom obvode vzniká elektrický prúd.
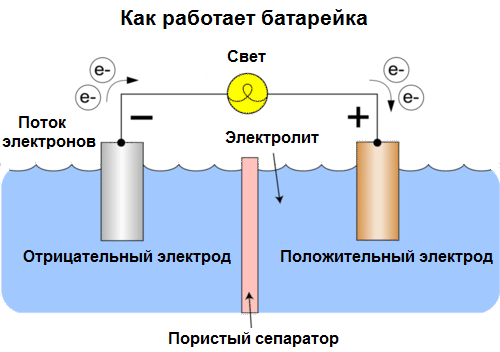
Napätie batérie závisí od použitých kovov a od počtu článkov v „batérii“. Batérie na rozdiel od batérií nie sú schopné obnoviť svoje vlastnosti, pretože priamo premieňajú chemickú energiu, tj energiu činidiel (redukčných činidiel a oxidantov), ktoré tvoria batériu, na elektrickú energiu.
Činidlá obsiahnuté v batérii sa počas prevádzky spotrebúvajú, prúd sa postupne znižuje, a preto činnosť zdroja končí, keď reagenty úplne reagujú.
Alkalické a soľné prvky (batérie) sa často používajú na napájanie rôznych elektronických zariadení, rádiových zariadení, hračiek a lítium, ktoré sa najčastejšie nachádzajú v prenosných lekárskych prístrojoch, ako sú glukomery alebo digitálna technológia, ako sú fotoaparáty.

Soľné batérie
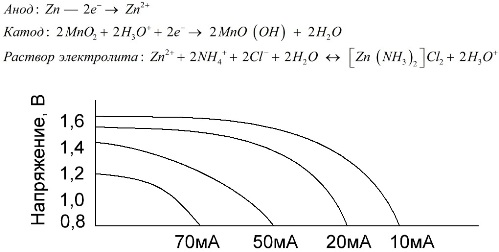
Mangán-zinkové články, ktoré sa nazývajú slané batérie, sú „suché“ galvanické články, v ktorých nie je tekutý roztok elektrolytu.
Zinková elektróda (+) je kalíškovitá katóda a ako anóda slúži prášková zmes oxidu manganičitého a grafitu. Prúd tečie cez grafitovú tyč. Ako elektrolyt sa pasta používa z roztoku chloridu amónneho s pridaním škrobu alebo múky na zahusťovanie, takže nič neprúdi.
Výrobcovia batérií zvyčajne neuvádzajú presné zloženie slaných prvkov, slané batérie sú však najlacnejšie, zvyčajne sa používajú v zariadeniach, kde je spotreba energie extrémne nízka: v hodinách, v diaľkových ovládačoch, v elektronických teplomeroch atď.

Pojem „menovitá kapacita“ sa zriedka používa na charakterizáciu mangán-zinkových batérií, pretože ich kapacita je vysoko závislá od prevádzkových podmienok a podmienok. Hlavnou nevýhodou týchto prvkov je výrazné zníženie napätia počas vybíjania a značné zníženie výstupnej kapacity so zvyšujúcim sa vybíjacím prúdom. Konečné vybíjacie napätie sa nastavuje v závislosti od zaťaženia v rozsahu 0,7 - 1,0 V.
Je dôležité nielen veľkosť vybíjacieho prúdu, ale aj časový rozvrh zaťaženia. Pri prerušovanom vybíjaní veľkých a stredných prúdov sa výkon batérií v porovnaní s nepretržitou prevádzkou výrazne zvyšuje. Pri malých výbojových prúdoch a mesiacoch prerušenia prevádzky sa však ich kapacita v dôsledku samovybíjania môže znížiť.
Vyššie uvedený graf ukazuje krivky vybitia priemernej slanej batérie po dobu 4, 10, 20 a 40 hodín v porovnaní s alkalickou batériou, o ktorej sa bude diskutovať neskôr.
Alkalické (alkalické) batérie
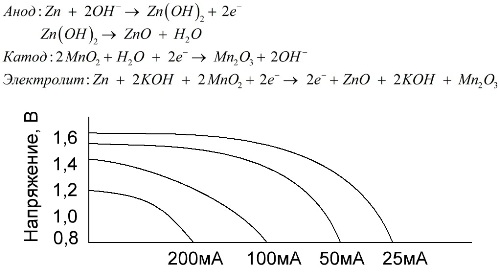
Alkalická batéria je galvanická batéria z mangánu a zinku, v ktorej sa ako katóda používa oxid manganičitý, ako anóda sa používa práškový zinok a ako elektrolyt sa používa alkalický roztok, zvyčajne vo forme pasty hydroxidu draselného.
Tieto batérie majú množstvo výhod (najmä podstatne väčšiu kapacitu, lepší výkon pri nízkych teplotách a vysoké zaťažovacie prúdy).

Alkalické batérie môžu v porovnaní so soľným roztokom poskytovať dlhší čas viac prúdu. Vyšší prúd je možný, pretože tu nie je použitý zinok vo forme skla, ale vo forme prášku, ktorý má väčšiu kontaktnú plochu s elektrolytom. Hydroxid draselný vo forme pasty sa používa ako elektrolyt.
Je to vďaka schopnosti tohto typu galvanických článkov dlhodobo dodávať významný prúd (až 1 A), v súčasnosti sú alkalické batérie najbežnejšie.
V elektrických hračkách, v prenosných zdravotníckych zariadeniach, v elektronických zariadeniach, v kamerách sa všade používajú alkalické batérie. Slúži 1,5-krát dlhšie ako soľný roztok, ak je výboj nízky. Graf ukazuje výbojové krivky pri rôznych prúdoch pre porovnanie so soľnou batériou (graf bol uvedený vyššie) počas 4, 10, 20 a 40 hodín.
Lítiové batérie
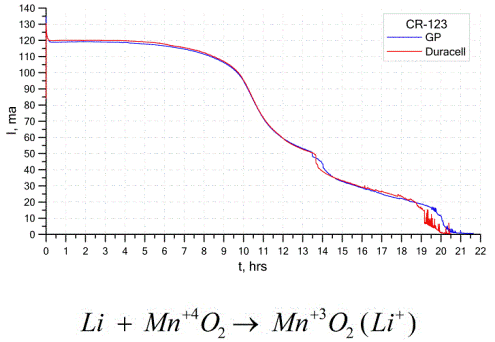
Ďalším pomerne bežným typom galvanických článkov sú lítiové batérie - jednotlivé nenabíjateľné galvanické články, v ktorých sa lítium alebo jeho zlúčeniny používajú ako anóda. Vďaka použitiu alkalického kovu majú vysoký potenciálový rozdiel.

Katóda a elektrolyt lítiového článku môžu byť veľmi odlišné, takže pojem „lítiový článok“ kombinuje skupinu článkov s rovnakým materiálom anódy.Ako katóda sa môže použiť napríklad oxid manganičitý, monofluorid uhličitý, pyrit, tionylchlorid atď.
Lítiové batérie sa líšia od ostatných batérií podľa ich vysokej doby prevádzky a vysokých nákladov. Podľa zvolenej veľkosti a použitých chemických materiálov môže lítiová batéria vytvárať napätie od 1,5 V (kompatibilné s alkalickými batériami) do 3,7 V.
Tieto batérie majú najvyššiu kapacitu na jednotku hmotnosti a dlhú životnosť. Lítiové články sa široko používajú v moderných prenosných elektronických zariadeniach: na napájanie hodiniek na základných doskách počítačov, na napájanie prenosných lekárskych prístrojov, hodiniek, kalkulačiek, vo fotografických zariadeniach atď.
Graf vyššie ukazuje krivky vybíjania pre dve lítiové batérie od dvoch populárnych výrobcov. Počiatočný prúd bol 120 mA (na rezistor rádovo 24 Ohmov).
Pozri tiež: Moderné nabíjateľné batérie - výhody a nevýhody
Pozri tiež na electro-sk.tomathouse.com
: