kategória: Začiatočníci elektrikári, Priemyselný elektrikár
Počet zobrazení: 37528
Komentáre k článku: 0
Praktická aplikácia elektrolýzy
Keď elektrický prúd prechádza roztokom alebo taveninou elektrolytu, na elektródach sa uvoľňujú rozpustené látky alebo iné látky, ktoré sú produktmi sekundárnych reakcií na elektródach. Tento fyzikálno-chemický proces sa nazýva elektrolýza.
Podstata elektrolýzy
V elektrickom poli vytvorenom elektródami ióny vo vodivej tekutine prichádzajú usporiadaným pohybom. Záporná elektróda je katóda, kladná je anóda.
Záporné ióny nazývané anióny (ióny hydroxylovej skupiny a zvyšky kyselín) sa vháňajú do anódy a kladné ióny nazývané katióny (vodíkové, kovové, amónne ióny atď.) Sa vrhajú na katódu
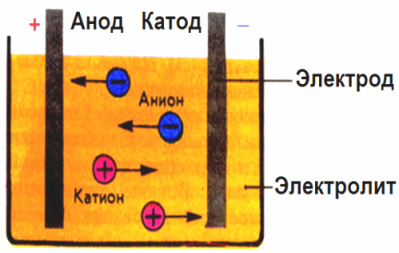
Na elektródach prebieha oxidačno-redukčný proces: pri katóde dochádza k elektrochemickej redukcii častíc (atómov, molekúl, katiónov) a pri anóde dochádza k elektrochemickej oxidácii častíc (atómov, molekúl, aniónov). Disociačné reakcie v elektrolyte sú primárne reakcie a reakcie, ktoré prebiehajú priamo na elektródach, sa nazývajú sekundárne.
Zákony Faradayovej elektrolýzy
Rozdelenie elektrolytických reakcií na primárne a sekundárne pomohlo Michaelovi Faradayovi ustanoviť zákony elektrolýzy:
-
Prvý zákon Faradayovej elektrolýzy: hmotnosť látky nanesenej na elektródu počas elektrolýzy je priamo úmerná množstvu elektriny prevedenej na túto elektródu. Množstvo elektriny znamená elektrický náboj meraný spravidla v príveskoch.
-
Druhý zákon Faradayovej elektrolýzy: pre dané množstvo elektriny (elektrický náboj) je hmotnosť chemického prvku uloženého na elektróde priamo úmerná ekvivalentnej hmotnosti prvku. Ekvivalentná hmotnosť látky je jej molárna hmotnosť delená celým číslom, v závislosti od chemickej reakcie, ktorej sa látka týka.
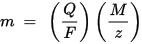
m je hmotnosť látky uloženej na elektróde, Q je celkový elektrický náboj prechádzajúci látkou F = 96,485,33 (83) C mol - 1 je Faradayova konštanta, M je molárna hmotnosť látky (napríklad molárna hmotnosť vody H2O = 18 g / mol), z je valenčný počet iónov látky (počet elektrónov na ión).
Pamätajte, že M / z je ekvivalentná hmotnosť zrážanej látky. Pre prvý Faradayov zákon sú M, F a z konštanty, takže čím väčšia je hodnota Q, tým väčšia je hodnota m. Podľa druhého Faradayovho zákona sú Q, F a z konštanty, takže čím väčšia je hodnota M / z (ekvivalentná hmotnosť), tým väčšia je hodnota m.
Elektrolýza sa dnes v priemysle a technike často používa. Napríklad elektrolýza slúži ako jedna z najúčinnejších metód na priemyselnú výrobu vodíka, peroxidu vodíka, oxidu manganičitého, hliníka, sodíka, horčíka, vápnika a ďalších látok. Elektrolýza sa používa na čistenie odpadových vôd, pri elektrolytickom pokovovaní, pri pokovovaní elektrolytom a nakoniec v zdrojoch chemického prúdu. Ale prvé veci ako prvé.
Získanie čistých kovov z rúd elektrolýzou
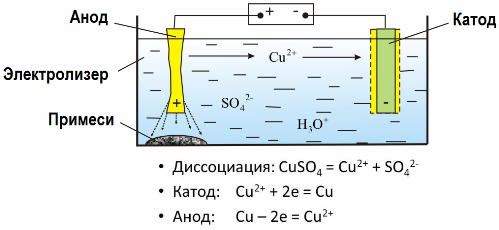
Vďaka elektrolýze sa veľa kovov extrahuje z rúd a ďalej sa spracováva. Ak sa teda ruda alebo obohatený rudný koncentrát spracuje s činidlami, kov prechádza do roztoku a potom sa elektroextrakciou kov z roztoku izoluje. Čistý kov sa uvoľňuje súčasne na katóde. Týmto spôsobom prijímajú zinok, meď a kadmium.
Kovy sa podrobia elektrolytickému rafinovaniu, aby sa odstránili nečistoty a premena obsiahnutých nečistôt na formu vhodnú na ďalšie spracovanie. Kov, ktorý sa má vyčistiť, sa odlieva vo forme dosiek a tieto dosky sa používajú ako anódy pri elektrolýze.
Keď prúd prechádza, kov anódy sa rozpúšťa, prechádza vo forme katiónov do roztoku, potom sú katióny na katóde vypúšťané a tvoria zrazeninu čistého kovu. Nečistoty anódy sa nerozpúšťajú - precipitujú s anódovou suspenziou alebo prechádzajú do elektrolytu, odkiaľ sú kontinuálne alebo periodicky odstraňované.
Zoberme si ako príklad medené elektrolytické rafinovanie, Hlavnou zložkou roztoku - síran meďnatý - najbežnejšia a najlacnejšia soľ tohto kovu. Roztok má nízku elektrickú vodivosť. Na jeho zvýšenie sa do elektrolytu pridáva kyselina sírová.
Ďalej sa do roztoku zavedie malé množstvo prísad, aby sa uľahčila tvorba kompaktnej kovovej zrazeniny. Meď, nikel, olovo, cín, striebro a zlato sa všeobecne elektrolyticky rafinujú.
Elektrolytické čistenie odpadových vôd
Elektrolýza sa používa pri čistení odpadových vôd (procesy elektrokoagulácie, elektroextrakcie a elektroflotácie). Elektrochemická metóda čistenia je jednou z najbežnejšie používaných metód. Na elektrolýzu sa používajú nerozpustné anódy (magnetit, oxid olovnatý, grafit, mangán, ktoré sa ukladajú na titánovej báze) alebo sú rozpustné (hliník, železo).
Táto metóda sa používa na izoláciu toxických organických a anorganických látok z vody. Napríklad medené rúry sa čistia z vodného kameňa roztokom kyseliny sírovej a priemyselné odpadové vody sa potom musia čistiť elektrolýzou s nerozpustnou anódou. Meď sa uvoľňuje na katóde, ktorú je možné opäť použiť v rovnakom podniku.
Alkalická odpadová voda sa čistí elektrolýzou z kyanidových zlúčenín. Na urýchlenie oxidácie kyanidov, zvýšenie elektrickej vodivosti a úspory energie sa vo vode používa prísada vo forme chloridu sodného.
Elektrolýza sa uskutočňuje grafitovou anódou a oceľovou katódou. Kyanidy sa ničia pri elektrochemickej oxidácii a chlóru, ktorý sa uvoľňuje na anóde. Účinnosť takého čistenia je takmer 100%.
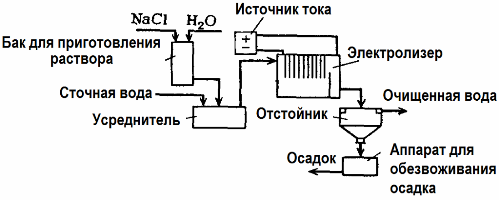
Okrem priameho elektrochemického čistenia sa môže zahrnúť aj do elektrolýzy koagulácia, S výnimkou pridania solí sa elektrolýza vykonáva pomocou rozpustných anód hliníka alebo železa. Potom sú zničené nielen kontaminanty na anóde, ale samotná anóda sa rozpustí. Vytvoria sa aktívne dispergované zlúčeniny, ktoré koagulujú (zahusťujú) koloidné dispergované kontaminanty.
Táto metóda je účinná pri úprave odpadovej vody z tukov, ropných produktov, farbív, olejov, rádioaktívnych látok atď. Nazýva sa elektrokoagulácia.
zinkovanie
Galvanické pokovovanie je elektrolytické vylučovanie určitých kovov s cieľom chrániť výrobky pred koróziou a poskytnúť im vhodný estetický vzhľad (povlak je vyrobený z chrómu, niklu, striebra, zlata, platiny atď.). Táto látka sa dôkladne vyčistí, odmastí a použije sa ako katóda v elektrolytickom kúpeli, v ktorom sa naleje soľný roztok kovu, ktorým je potrebné obaliť výrobok.
Doska z rovnakého kovu sa používa ako anóda. Spravidla sa používa dvojica anódových dosiek a predmet, ktorý sa má galvanizovať, sa umiestni medzi ne.
galvanoplastice
Galvanické pokovovanie - nanášanie kovu na povrch rôznych telies na reprodukciu ich tvarov: formy na odlievanie častí, sochy, tlačené klišé atď.

Galvanické nanášanie kovu na povrch predmetu je možné iba vtedy, keď je tento povrch alebo celý predmet vodičom elektrického prúdu, preto sa pri výrobe modelov alebo tvarov odporúča používať kovy. Na tento účel sú najvhodnejšie taviteľné kovy: olovo, cín, spájky, zliatina dreva.
Tieto kovy sú mäkké, ľahko sa spracovávajú kovovými nástrojmi, sú dobre vyryté a odlievané. Po vytvorení galvanickej vrstvy a dokončení sa kov z formy vytaví z hotového výrobku.
Najväčšie príležitosti na výrobu modelov však stále predstavujú dielektrické materiály. Na pokovovanie takýchto modelov je potrebné poskytnúť povrchovej elektrickej vodivosti. Úspech alebo neúspech závisí v konečnom dôsledku hlavne od kvality vodivej vrstvy. Túto vrstvu je možné aplikovať jedným z troch spôsobov.
Najbežnejším spôsobom je grafitirovanie, je vhodný pre modely z plastelíny a iných materiálov, ktoré umožňujú brúsenie grafitu na povrchu.
Ďalší trik je samoopaľovacieTento spôsob je vhodný pre modely relatívne zložitého tvaru, pre rôzne materiály je však prenos malých častí v dôsledku hrúbky bronzovej vrstvy trochu zdeformovaný.
A nakoniec striebrenievhodné vo všetkých prípadoch, ale najmä nevyhnutné pre krehké modely s veľmi komplexným tvarom - rastliny, hmyz atď.
Zdroje chemického prúdu
Elektrolýza je tiež hlavným procesom, vďaka ktorému fungujú najmodernejšie zdroje chemického prúdu, ako sú batérie a akumulátory. S elektrolytom sú v kontakte dve elektródy.
Medzi elektródami sa vytvára potenciálny rozdiel - elektromotorická sila zodpovedajúca voľnej energii redoxnej reakcie. Viac informácií nájdete tu: Chemické zdroje elektrického prúdu
Citrónová batéria (kliknutím na obrázok zväčšíte)
Pôsobenie zdrojov chemického prúdu je založené na výskyte priestorovo oddelených procesov s uzavretým vonkajším okruhom: na zápornej anóde sa oxiduje redukčné činidlo, voľné elektróny, ktoré sa tvoria, prechádzajú cez vonkajší obvod do kladnej katódy a vytvárajú výbojový prúd, kde sa zúčastňujú oxidačnej redukčnej reakcie. Tok záporne nabitých elektrónov pozdĺž vonkajšieho obvodu teda prechádza od anódy k katóde, to znamená od zápornej elektródy k kladnej.
Pozri tiež na electro-sk.tomathouse.com
: